Giardien waren bei Mäusen recht seltene Parasiten. Inzwischen scheinen sie sich jedoch recht weit verbreitet zu haben. Da die infizierten Nager oft symptomlos sind, wird die Notwendigkeit einer Behandlung teils heftig diskutiert. Angeraten ist sie aus 2 Gründen: Prägen sich doch Symptome aus, ist die Mortalität recht hoch. Außerdem werden Giardien sehr leicht weiterverschleppt – auch an Arten, die auf den Parasiten empfindlicher reagieren, und auf den Menschen. Eine Behandlung ist daher zumindest in der Mehrheit der Fälle sinnvoll.
Der Parasit
Es gibt mehrere Arten von Protozoen der Gattung Giardia. Bei Mäusen am häufigsten ist Giardia muris, die auch Ratten, Hamster und andere Nager sowie den Menschen befällt. Darüber hinaus finden sich auch andere Arten bei Nagern (z.B. G. duodenalis). Neuere Forschung legt nahe, dass G. muris eine Form von G. duodenalis ist.
Bei Ratten zu finden ist neben G. muris auch G. duodenalis.
Der birnenförmige Parasit bewegt sich im Darm mit vier Geißelpaaren fort und kann sich fest an die Darmwand anheften.
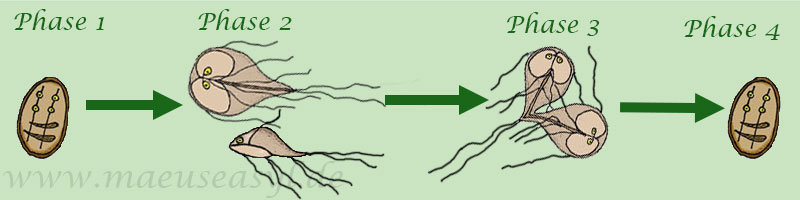
Nach der Infektion über das Maul schlüpfen im Zwölffingerdarm aus jeder vierkernigen Zyste, der Dauerform der Giardien, 2 Trophozoiten. Die besiedeln den Darm und dessen Schleimhautoberfläche. Dabei heften sie sich mit einer speziellen Haftscheibe an die Zellen des Epithels. Dort entziehen sie dem Wirt Kohlehydrate, von denen sie sich ernähren.
Die Vermehrung der Einzeller geschieht durch Längsteilung, bevor sie bei ihrer Wanderung durch den Verdauungstrakt im vorderen Teil des Dünndarms (Jejenum) und im Blinddarm wegen des alkalischen pH-Wertes widerstandsfähige Zysten bilden. Diese Zysten sind erst zwei-, später vierkernig.
Die vierkernigen Zysten werden dann mit dem Kot wieder in die Umwelt ausgeschieden, wo sie im Kotballen ca. 1 Woche, im Boden je nach Umweltbedingungen zwischen 7 Wochen und 3 Monaten überleben. Bei Frost unter -4°C und Wärme über 25°C sterben die Zysten innerhalb einer Woche ab. In verflüssigtem Kot blieben die Zysten ein Jahr infektiös.
Giardien im Überblick
- ca. 7 – 13 × 5 – 10μm
- Einzeller
- im Kot nicht sichtbar
- Zoonose
Übertragung von Giardien
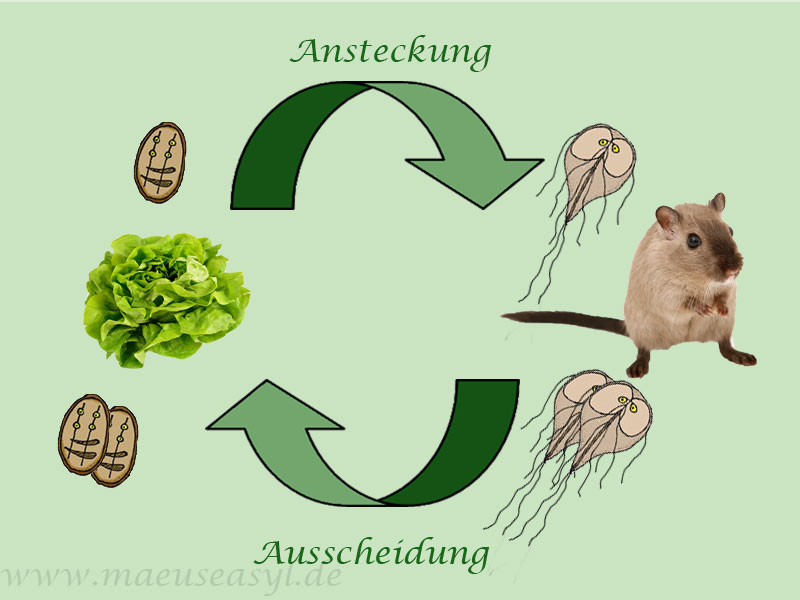
Übertragen werden Giardien über die orale Aufnahme, meist entweder durch verunreinigtes Futter oder Trinkwasser. Je nach Quelle wird eine sichere oder mögliche Durchseuchung bei Mäusen von 100% angegeben. Wie hoch die Durchseuchung der Haustierpopulation aktuell (Stand 2020) allerdings tatsächlich ist, ist nicht ausreichend untersucht.
Neben G. muris kann auch G. duodenalis Mäuse befallen. Diese Giardie ist bei Chinchillas, aber auch bei Kaninchen und anderen Kleinsäugern häufig zu finden. Sie wird beispielsweise durch den Kot der Tiere übertragen, wenn Nager die Möglichkeit haben, auf den Mäusegehegen zu sitzen und hineinzukoten. Auch über das gemeinsame Spülen von Futtergeschirr können Giardien übertragen werden.
Ein infiziertes Muttertier kann die Parasiten auf ihren Nachwuchs übertragen.
Es gibt Studien, die nahelegen, dass Giardien-Stämme bis zu einem bestimmten Punkt wirtsspezifisch sind. So ließen sich mit Giardia muris aus Mäusen andere Mäuse und Hamster infizieren, nicht aber Ratten. Ratten können aber sehr wohl bestimmte Stämme von G. muris tragen.
Zudem kann die Empfänglichkeit für Giardien bei Farbmäusen von Linie zu Linie zu Linie sehr unterschiedlich sein. Zudem scheinen Weibchen dem Parasiten mehr entgegenzusetzen zu haben als Männchen. Die Giardien vermehren sich in ihnen schlechter und die Weibchen scheiden später Cysten aus als Männchen.
Übertragung durch:
- fäkal-oral
- verschmutztes Futter
- verschmutztes Wasser
- verschmutztes Futtergeschirr
- verschmutzte(s) Streu oder Inventar
- Kontakt zu Kot anderer, infizierter Haustiere
Symptome bei Giardien
Die meisten Infektionen mit Giardien verlaufen asymptomatisch und werden daher nicht bemerkt. Ihnen folgt oft eine mehrmonatige, in seltenen Fällen mehrjährige, chronische Phase, der schließlich die Ausheilung folgt. Danach ist die Maus partiell immun.
Kommen jedoch weitere Erkrankungen hinzu oder liegt eine Immunschwäche vor, kann sich der Parasit massenhaft vermehren und löst dann auch sichtbare Symptome aus. So kommt es durch den starken Befall zu einer Schleimhautentzündung im Zwölffinger- und Dünndarm, die von einer Zottenrückbildung und der mehr oder minder großflächigen Abstoßung von Epithelzellen begleitet wird. Dies beeinträchtigt die Darmfunktion und es kommt zu einem Verlust von Proteinen und Wasser sowie einer verschlechterten Aufnahme von Kohlehydraten, Fetten und Vitaminen.
Von außen erkennt der Halter die Erkrankung dann vor allem am verschmierten Po durch die breiigen bis flüssigen, selten auch blutigen Durchfälle. Außerdem oft zu beobachten sind Blähungen, Apathie, schlechtes Fell und eine gekrümmte Körperhaltung. Bei betroffenen Jungtieren kommt es auch zu Wachstumsstörungen. Meist tritt die Erkrankung bei ihnen mit der Entwöhnung ein.
Kohlehydratreiche Ernährung fördert Erkrankung, die eine sehr hohe Sterblichkeitsrate aufweist, wenn sie ausgebrochen ist.
Symptome im Überblick
- Enteritis
- teils massive Durchfälle
- kotverklebte Analregion
- Blähungen
- Apathie
- schlechtes Fell
- gekrümmte Haltung
- Wachstumsstörungen
Diagnose von Giardien
Nachgewiesen werden kann ein Giardienbefall durch das Auffinden von Zysten im Kot unter dem Mikroskop. Bei manifesten Durchfallerkrankungen sind auch Trophozoiten im Kot bei nativem Ausstrich nachweisbar. Auch das Flotationsverfahren oder verschiedene Konzentrationsverfahren können zum Nachweis verwendet werden. Allerdings ist das Flotationsverfahren ein eher unsicherer Test, der auch falsch negativ ausfallen kann.
Zysten und Trophozoiten werden nicht ständig ausgeschieden, ein Antigen für Giardien dagegen ist permanent vorhanden. Auf dieses Antigen zielen Tests wie der ELISA-Antigen-Test, die mit Kosten von etwa 25 Euro nicht ganz günstig sind, jedoch einfacher, schneller und sehr zuverlässig. Allerdings unterscheiden diese Tests in der Regel nicht zwischen toten und lebenden Giardien. Daher kann ein zu früh durchgeführter Nachtest noch falsch positiv ausfallen, obwohl die Behandlung erfolgreich war, da noch tote Giardien ausgeschieden werden.
Einen Test, der in frischem Kot ausschließlich lebende Giardien und damit einen aktiven Befall nachweist, stellen derzeit nur die Veterinäruni Gießen und das Tierärztliche Labor Freiburg zur Verfügung. Diese Tests suchen nach einem Protein, das Giardien nur während der Teilung abgeben. Sie schlagen bei toten Parasiten also nicht falsch negativ an.
Außerdem können Giardien über einen PCR-Test nachgewiesen werden.
Checkliste Diagnose
- nativer Kotausstrich
- Flotationsprobe
- ELISA-Antigen-Test
- PCR-Test
Unter dem Mikroskop im Direktausstrich deutlich erkennbar: die mobile, sehr bewegliche Giardie
Behandlung - Giardien bekämpfen
Giardien haben über die Jahre zahlreiche Resistenzen aufgebaut. Je nach Stamm, der Ihren Nager befallen hat, müssen Sie sich also im schlimmsten Fall durch mehrere Präparate probieren. Mitunter greifen nur noch Wirkstoffkombinationen.
Für die Behandlung von Giardien gibt es eine ganze Reihe von Medikamenten, wobei Panacur (Fenbendazol) und Metronidazol die gebräuchlichsten sind. Panacur hat sich bei Mäusen und anderen Kleinnagern allerdings als mit vereinzelt schweren Nebenwirkungen und sogar Todesfällen behaftet erwiesen. Daher sollte Panacur nicht unbedingt das erste Präparat der Wahl sein.
Checkliste Behandlung
- Metronidazol
- Flubendazol
- Fenbendazol
- Ronidazol
- Dimetridazol
- Tinidazol
- strikte Umgebungshygiene
Für verschiedene Wirkstoffe sind hier in Kürze die Dosierungen mit Gabezeiten und -arten für Mäuse aufgeführt. Dosierungen für weitere Arten und Hinweise zu den Wirkstoffen entnehmen Sie bitte dem Link zum jeweiligen Wirkstoff (mit der Mouse über den Wirkstoff fahren).
| Wirkstoff | Dosierung | Turnus | Periode | Gabe |
|---|---|---|---|---|
| Fenbendazol | 0,5mg/10g | 1x täglich | 10 Tage | oral |
| Flubendazol | 0,1mg/10g | 1x täglich | 10 Tage | oral |
| Metronidazol |
|
| 10 Tage | oral , subkutan |
Dosierungen für die Gabe über das Trinkwasser:
| Wirkstoff | Dosierung | Periode |
|---|---|---|
| Dimetridazol (Emtryl) |
| 10 Tage |
| Metronidazol (Flagyl) | 2,5mg/ml | 10 Tage |
| Ronidazol | 4mg/ml | 10 Tage |
| Tinidazol (Simplotan) | 2,5mg/ml | 10 Tage |
In schweren Fällen ist die Gabe von Metronidazol auch bis zu 6 Wochen möglich. Da Zysten auch noch einige Tage nach der Medikamentengabe ausgeschieden werden können, empfiehlt es sich, die Kur nach 5 Tagen zu wiederholen. So vermeiden Sie eine erneute Ansteckung.
In der Praxis bewährt haben sich im Mäuseasyl auch TKK-Tabletten mit dem Hauptwirkstoff Ronidazol als orale Medikation über 10 Tage. Diese gebe ich gemörsert in etwas Naturjoghurt, sodass sie sich besser eingeben lassen. Bewährt haben sich hier 4 Tabletten auf ca. 30 Farbmäuse von durchschnittlich 30 bis 40g Körpergewicht. Darin eingerechnet ist schon, dass der Wirkstoff nicht gut schmeckt und in Teilen gern wieder ausgespuckt oder an Streu, Nistmaterial u. ä . abgeschmiert wird. Bisher wurde der Wirkstoff in dieser Pi-mal-Daumen-Dosierung gut und ohne sichtbare Nebenwirkungen vertragen. Von bisher 122 behandelten Farb- und 2 Vielzitzenmäusen gab es einen spontanen Exitus eines vorher klinisch unauffälligen Farbmauskastraten. Hier kann ich nicht ausschließen, dass die Therapie daran beteiligt oder ursächlich für den Tod war. Für eine statistisch belastbare Aussage ist die behandelte Tierzahl aber ohnehin noch zu klein.
Begleitende Behandlung bei Giardien
Bei massivem Befall sollten Sie zusätzlich ein Antibiotikum (z.B. Baytril) geben, soweit das Mittel der Giardienbehandlung an sich noch keines ist. So reduzieren Sie das Risiko einer Enterotoxämie, einer Vergiftung durch Toxine aus einer engleisten Darmflora.
Unterstützend ist eine symptomatische Behandlung unbedingt notwendig. Je nach Stärke des Durchfalls sind dies Bene Bac, Dysticum (mit Joghurt vermischt), bei starken Durchfällen können auch subkutane Flüssigkeitsdepots nötig werden. Ist das Tier aufgebläht, empfiehlt sich die Gabe von Sab Simplex gegen die Aufgasung und bei starken Blähungen Metacam gegen die Blähungsschmerzen. Da die Mäuse schnell viel Gewicht verlieren, ist auch die Gabe eines – nach Möglichkeit kohlenhydratarmen – Päppelbreis und eines Vitamin-B-Komplex ratsam.
Außerdem können sie den/die Patienten für die Dauer der Behandlung auf kohlenhydratarme Kost umstellen. Das bedeutet eine Saatenbasis aus Ölsaaten und sehr proteinreichen Saaten, dazu tierisches Protein. Soweit Ihre Patienten keinen akuten Durchfall haben, können Sie auch jegliches für Ihre Nager verträgliche Gemüse, Kräuter und Blätter verfüttern. Auf Obst und getreidelastige Saatenmixe mit verschiedenen Großgetreiden und Hirsen sollten Sie verzichten.
Checkliste Begleitbehandlung
- Antibiotikum
- Dysticum (mit Joghurt)
- Infusionen
- Bene Bac
- Sab Simplex
- Meloxicam
- Vitamin-B-Komplex
- kohlenhydratarme Diät
Der Quarantänekäfig
Der Quarantänekäfig sollte leicht zu reinigen sein und nach Möglichkeit ein Rauskrümeln von Material wie Streu oder Futterresten verhindern. Dunas, Makrolonboxen und Aquarien haben sich hier am besten bewährt.
Als Einstreu können Sie Küchenkrepp, Klopapier oder Safebed in Flocken- oder Streifenform nutzen. Sie können aber auch ganz normale Holz-, Hanf oder andere Einstreu und jeden anderen Untergrund verwenden, den Sie im normalen Gehege auch anbieten. Organische Bodengründe sollten Sie allerdings nicht – soweit bei Ihnen üblich – auf dem Kompost oder in der Biotonne entsorgen, sondern im Restmüll. So vermeiden Sie es, die Parasiten nach draußen zu verschleppen.
Reinigen Sie den Quarantänekäfig mindestens alle 2 Tage, bei massivem Befall oder bei großen Gruppen täglich. Dafür leeren Sie den Käfig komplett, säubern ihn Wasser und Seife. Anschließend gehen Sie einmal mit dem Dampfreiniger durch oder brühen das Innere mit kochendem Wasser ab.
Inventar behandeln Sie – soweit möglich – genauso. Schlecht oder nicht zu reinigendes Inventar sollten Sie mindestens 1,5 Wochen bei -4°C einfrieren oder bei 90°C 30min lang ausbacken. Alternativ können Sie auch einfach Schachteln, Pappröhren u. Ä. als Einweginventar verwenden und nach Gebrauch entsorgen.
Verwenden Sie für die Quarantäne ausschließlich Wasserflaschen, keine Schüsseln. So senken Sie das Risiko einer permanenten Reinfektion.
Checkliste Quarantänekäfig
- abwaschbar
- heiß desinfizierbar oder chemisch sehr beständig
- krümelfrei
- Einweg- oder heiß/chemisch desinfizierbares Inventar
- Zellstoff und/oder Safebed
- nur Wasserflaschen verwenden
Wie kriege ich das Gehege wieder sauber?
Die ausgeschiedenen Dauerstadien der Giardien überleben am besten in feucht-kühlem Klima. Wärme und Trockenheit lassen sie daher schneller absterben. Trotzdem ist Aussitzen nur eine Option, wenn Sie das Gehege nach der einfachen Grundreinigung min. 3 Monate lang nicht nutzen.
Wollen Sie nicht so lange warten, leeren Sie das Gehege und entsorgen Sie die gesamte Einstreu im Restmüll. Das mit Wasser und Spülmittel vorgereinigte Gehege können Sie mit Dampfreiniger behandeln und so reinigen, indem Sie die gesamte Oberfläche langsam und gründlich abdampfen. Glatte Flächen können Sie auch mit chlorkresolhaltigen Desinfektionsmitteln (z.B. Neopredisan, 2% über min. 4h Einwirkzeit) desinfizieren. Milde Desinfektionsmittel wie Bactazol wirken nicht gegen Giardien.
Für das Inventar gilt Ähnliches. Mit Wasser und Seife vorgereinigtes Mobiliar können Sie einfrieren, abdampfen, abbrühen oder ausbacken.
Eingangsquarantäne bei Giardien
Die Eingangsquarantäne ist bei Giardien recht unkompliziert, wenn Sie grundlegende Hygieneregeln (nichts verkrümeln, gründlich Hände waschen) beachten. Sie bringen die ankommenden Tiere mit bekanntem Befall einfach gleich im krümelfreien, eingerichteten Quarantänebehälter unter und beginnen mit der Behandlung. Bei ungetesteten Tieren gilt dieselbe Unterbringung bis zum Testergebnis.
Können Streu und Kot aus dem Quarantänegehege nicht rausfallen und halten Sie eine gründliche Handhygiene ein, bauen Sie einer Verbreitung von Giardien auf andere Nager, weitere Tiere oder Menschen im Haushalt schon gut vor. Legen Sie sich für die Behandlungsdauer außerdem separates Putzzeug für Schüsseln, Flaschen, Mobiliar und Käfig zu, um darüber die Giardien nicht an andere Tiere im Haushalt zu verschleppen.
Unterstützen Sie dieses Projekt! 🙂
Das Mäuseasyl steht für fundierte, praxisnahe Informationen. Für einen Artikel brauche ich deshalb zwischen 2 und 30 Stunden, um diesen zu schreiben, Fotos, Zeichnungen und Videos zu machen und zu bearbeiten und die Seite strukturiert zusammenzustellen. Diese Seite ist also ein Full Time Job! Wenn Ihnen dieser Artikel hilfreich war, unterstützen Sie das Projekt bitte mit einer kleinen Summe. Die verschiedenen Möglichkeiten können Sie hier nachlesen: https://das-maeuseasyl.de/was-passiert-mit-meinem-kaffeegeld/
Quellen
Anderson, Fox, et al.: Laboratory Animal Medicine, 3. Aufl., Academic Press 2015, S. 43ff. und 151ff.
Boch, Josef; Supperer, Rudolf; Schnieder, Thomas (Hrsg.): Veterinärmedizinische Parasitologie, Parey, 6. Aufl., 2006
Emmerich, I. U.; Hein, J.: Dosierungsvorschläge für Arzneimittel bei Kleinnagern, Kaninchen, Frettchen und Igeln: 2. Aufl., Thieme 2018; S. 66ff., 76ff., 126ff., 162ff.
Ewringmann, A.; Glöckner, B.: Leitsymptome bei Hamster Ratte, Maus und Rennmaus, Enke-Verlag 2008, S. 54ff.
Gabrisch, Karl; Zwart, Perneel: Krankheiten der Heimtiere; Schlütersche Verlagsgesellschaft, 7. Auflage, 2008
Lucius, Richard; Loos-Frank, Brigitte: Biologie von Parasiten; Springer, Berlin, 2. Aufl., 2007
Pantschev, Nikola; Beck; Wieland : Praktische Parasitologie bei Heimtieren – Kleinsäuger Vögel – Reptilien – Bienen; Schlütersche Verlagsgesellschaft, 1. Aufl., 2005, S. 79ff.
Fremdmedien:
Lena Repohl: Video Giardie
Letztes Update: 11.01.2022
